Ο επιπολασμός της Χρόνιας Αποφρακτικής Πνευμονοπάθειας (ΧΑΠ) αντανακλά τις καπνιστικές συνήθειες της κοινωνίας, αυξάνοντας σταθερά στους άνδρες μέχρι τα πρώτα χρόνια της δεκαετίας του 1990 και μετά μπαίνοντας σε ένα σταθερό επίπεδο. Στις γυναίκες η ΧΑΠ ήταν άλλοτε ασυνήθης, αλλά ο επιπολασμός έχει αυξηθεί και είναι ακόμα αυξανόμενη και αυτό οφείλεται στους αυξημένους ρυθμούς καπνίσματος στις γυναίκες.
Αν και το κάπνισμα του τσιγάρου, αλλά και της πίπας, του πούρου και άλλων ειδών καπνού αποτελούν αποδεδειγμένα τον σημαντικότερο παράγοντα ανάπτυξης της ΧΑΠ, μια σειρά εξωγενών και ενδογενών παραγόντων κινδύνου ενοχοποιούνται ως παράγοντες κινδύνου:
Εξωγενείς παράγοντες κινδύνου:
- Το κάπνισμα: η κατανάλωση τσιγάρων αποτελεί την κύρια αιτία ανάπτυξης και εξέλιξης της ΧΑΠ στις βιομηχανικές χώρες. Το 90% των ασθενών με χρόνια αποφρακτική πνευμονοπάθεια είναι ή υπήρξαν καπνιστές. 0 κίνδυνος εμφάνισης ΧΑΠ στους καπνιστές συνδέεται άμεσα με τη συνολική ποσότητα καπνού που έχουν εισπνεύσει. Η ηλικία έναρξης του καπνίσματος, ο βαθμός καπνίσματος και η τρέχουσα καπνιστική συνήθεια θεωρούνται προγνωστικοί παράγοντες όσον αφορά την θνησιμότητα της ΧΑΠ. Μεταξύ των καπνιστών, ο επιπολασμός της ΧΑΠ σύμφωνα με τα κριτήρια κατά GOLD είναι 11% στα άτομα ηλικίας 46-47 ετών, 42% στα άτομα ηλικίας 61-62 ετών και 50% στα άτομα ηλικίας 66-67 ετών35. 0 επιπολασμός της ΧΑΠ είναι επομένως μεγαλύτερος σε χώρες όπου το κάπνισμα είναι διαδεδομένο. Η διακοπή του καπνίσματος είναι η μόνη αποτελεσματική παρέμβαση για τη μείωση του κινδύνου ανάπτυξης ΧΑΠ και εξέλιξης της νόσου. Το κάπνισμα εκτός του ότι αποτελεί τον κύριο παράγοντα κινδύνου για την ανάπτυξη της ΧΑΠ, ενισχύει επίσης και τη δράση όλων των άλλων παραγόντων κινδύνου. Κάθε καπνιστής με κατανάλωση περισσότερων από 20 πακέτα/έτη* αναπτύσσει χρόνια βρογχίτιδα. Όμως, μόνο το 20% των καπνιστών εμφανίζει ΧΑΠ, κάτι που θα μπορούσε να εξηγηθεί από τον ρόλο των ενδογενών παραγόντων στην παθογένεσή της. Το κάπνισμα:
- Παραλύει τους κροσσούς του κροσσωτού επιθηλίου, έτσι ώστε τα σωματίδια της σκόνης και η βρογχική βλέννα (με τα παθογόνα) δεν μπορούν πλέον να μεταφερθούν και να εξαχθούν προς την κατεύθυνση του ρινοφαρυγγικού χώρου. Με αυτόν τον τρόπο ευνοείται η δημιουργία λοιμώξεων της αναπνευστικής οδού.
- Αναστέλλει τα κυψελιδικά μακροφάγα, τα οποία είναι υπεύθυνα για την άμυνα εναντίον των λοιμώξεων του πνεύμονα.
- Οδηγεί σε υπερτροφία και υπερπλασία των κυττάρων του βρογχικού βλεννογόνου που οδηγούν σε αυξημένη έκκριση βλέννας.
- Ενισχύει τη δημιουργία βρογχοκυψελιδικής φλεγμονής με την πρόκληση οξειδωτικού στρες, απενεργοποίηση κυτταρικών αντιπρωτεασών (π.χ. α1-αντιθρυψίνη) και την επιστράτευση φλεγμονωδών κυττάρων (ιδιαίτερα των ουδετερόφιλων κοκκιοκυττάρων), από τα οποία απελευθερώνονται πρωτεάσες.
- Οδηγεί μέσω ερεθισμού των πνευμονογαστρικών υποδοχέων σε βρογχοσυστολή με αύξηση της αντίστασης της αναπνευστικής οδού.
- Παθητικό κάπνισμα: αν και μπορεί να οδηγήσει σε χρόνια βρογχίτιδα, δεν έχει διευκρινιστεί πλήρως η πιθανότητα εμφάνισης ΧΑΠ με το παθητικό κάπνισμα. Εάν υπάρχουν και άλλοι, κυρίως ενδογενείς παράγοντες κινδύνου για την ανάπτυξη ΧΑΠ θα πρέπει να λαμβάνεται υπόψη και η προσθετική αρνητική επίδρασή του.
- Υποτροπιάζουσες λοιμώξεις (ιικές και βακτηριακές) του αναπνευστικού συστήματος που εμφανίζονται πρόωρα στην παιδική ηλικία, συνδέονται με μειωμένη πνευμονική λειτουργία και αυξημένα συμπτώματα του αναπνευστικού στην ενήλικη ζωή.
- Διαταραχές της αύξησης και ανάπτυξης των πνευμόνων. Συνεπώς, κάθε παράγοντας που επηρεάζει την ανάπτυξη των πνευμόνων κατά την εμβρυϊκή και την παιδική ηλικία ενδέχεται να αυξάνει τον κίνδυνο του ατόμου να αναπτύξει ΧΑΠ κατά την ενήλικη ζωή. Το χαμηλό βάρος κατά τη γέννηση και οι οξείες λοιμώξεις του αναπνευστικού κατά την παιδική ηλικία έχουν συσχετιστεί με μειωμένη πνευμονική λειτουργία στην ενήλικη ζωή.
- Η μακροχρόνια εισπνοή αερίων (SO2, SH, NO, NO2 O3, χλωριούχα αέρια, φωσγένιο, φορμαλίνη κ.α.), υγρασίας και σκόνης (πυριτιούχα σκόνη, σκόνη βάμβακος, σκόνη δημητριακών, καπνός συγκόλλησης, ορυκτές ίνες, υλικά μόνωσης και πυρόσβεσης κ.α.) με μεγέθη σωματιδίων που μπορούν να διεισδύσουν στο βρογχικό δέντρο, μπορούν να προκαλέσουν από μόνα τους ΧΑΠ ή να επιταχύνουν την εξέλιξή της σε περίπτωση συνδυασμού με κάπνισμα.
- Ατμοσφαιρική ρύπανση η οποία προσθέτει στη συνολική επιβέρυνση των πνευμόνων σε εισπνεόμενα σωματίδια, παρόλο που ο ειδικός ρόλος στην πρόκληση της ΧΑΠ δεν έχει πλήρως κατανοηθεί.
- Στις υπανάπτυκτες χώρες η οικιακή εστία (ανοιχτή φωτιά ως εστία μαγειρέματος ή πηγή θέρμανσης μέσα στο σπίτι) παίζει έναν σημαντικό ρόλο στην εμφάνιση της ΧΑΠ.
*Πακέτα/έτη (pack years)=αριθμός των πακέτων τσιγάρων που καπνίζονται την ημέρα x αριθμό των ετών καπνίσματος ή αριθμός των τσιγάρων που καπνίζονται την ημέρα x αριθμό ετών καπνίσματος/20 (1 πακέτο περιέχει 20 τσιγάρα) (για online υπολογισμό κάντε κλικ εδώ).
Ενδογενείς παράγοντες:
Εκτός από τη χρόνια έκθεση σε εξωγενείς παράγοντες, σημαντικό ρόλο επίσης για την εμφάνιση και την εξέλιξη της ΧΑΠ παίζουν και μεμονωμένοι ενδογενείς παράγοντες:
- Η ανεπάρκεια της α1-αντιθρυψίνης: ο καλύτερα τεκμηριωμένος γενετικός παράγοντας κινδύνου για ΧΑΠ είναι η σοβαρή κληρονομική ανεπάρκεια της α-1 αντιθρυψίνης (ενός σημαντικού αναστολέα πρωτεάσης). Αυτό το σπάνιο υπολειπόμενο γνώρισμα παρατηρείται σε όλες τις εθνικότητες και τις φυλετικές ομάδες παγκοσμίως και ευθύνεται για ποσοστό μικρότερο από 1% του συνόλου των περιπτώσεων ΧΑΠ. Η α1-αντιθρυψίνη ανήκει στις σερπίνες (αναστολείς πρωτεϊνασών της σερίνης) που αδρανοποιούν πρωτεάσες της σερίνης, ιδιαίτερα αυτές που σχετίζονται δομικά με τη θρυψίνη. Από φυσιολογικής άποψης αποτελεί τον πιο σημαντικό αναστολέα της ελαστάσης των λευκοκυττάρων που απελευθερώνεται κατά τη διαδικασία φαγοκυττάρωσης από τα πολυμορφοπύρηνα λευκοκύτταρα και υποβάλει σε πέψη τον πνευμονικό ιστό. Το ένζυμο αυτό αντιδρά με την ελαστίνη στο τραχειοβροχικό δένδρο και το αγγειακό επιθήλιο. Η περίσσεια ελαστάσης ή η ανεπάρκεια α1-αντιθρυψίνης οδηγούν σε υψηλές συγκεντρώσεις μη ανεσταλμένης ελαστάσης με αποτέλεσμα την ανάπτυξη εμφυσήματος που συνήθως είναι πανλοβιδιακό με πιό συχνή προσβολή των κάτω πνευμονικών πεδίων κατά την 3η και 4η δεκαετία της ζωής. Συχνά προσβάλλονται και άλλα όργανα όπως το ήπαρ (χρόνια ηπατίτιδα, κίρρωση, ηπάτωμα), το δέρμα (λιπονέκρωση) και τα αγγεία (C-ANCA αγγείτιδες - κοκκιωμάτωση Wegener). Η ανεπάρκεια της α1-αντιθρυψίνης οφείλεται σε μεταλλάξεις του γονιδίου SERPINA1 που βρίσκεται στο χρωμόσωμα 14q και κληρονομείται με τον αυτοσωμικό χαρακτήρα. Οι πιο συχνές μεταλλάξεις είναι η Ζ (Glu342Lys) και S (Glu264Val) οι οποίες οδηγούν σε μείωση της συγκέντρωσης της πρωτεΐνης στο αίμα λόγω αδυναμίας αππέκρισής της από τα ηπατοκύτταρα. Στην περίπτωση ενός ομοζυγωτικού φαινοτύπου ZZ του οποίου η συχνότητα είναι περίπου 1/5000 άτομα στην Κεντρική και Βόρεια Ευρώπη και μικρότερη στη Νότια Ευρώπη, τα προστατευτικά επίπεδα της α1-αντιθρυψίνης μειώνονται στο 10-20% του φυσιολογικού, οπότε και δεν εξασφαλίζεται η επαρκής προστασία των πνευμόνων με αποτέλεσμα να αναπτύσσεται κατά κανόνα πνευμονικό εμφύσημα γύρω στην ηλικία των 40 ετών. Σε περίπτωση πρόσθετης κατανάλωσης νικοτίνης, το πνευμονικό εμφύσημα εμφανίζεται 10-15 χρόνια νωρίτερα. Οι ασθενείς με ετεροζυγωτικές μορφές έλλειψης α1-αντιθρυψίνης ή οι ασθενείς με ομοζυγωτική παραλλαγή SS αναπτύσσουν πνευμονικό εμφύσημα κατά κανόνα μόνο με ταυτόχρονη επίδραση επιπλέον παραγόντων κινδύνου (κάπνισμα, επαγγελματικές βλαβερές ουσίες, λοιμώξεις). Αν και η έλλειψη της α1-αντιθρυψίνης ευθύνεται για λιγότερο από το 1% των περιπτώσεων της χρόνιας αποφρακτικής πνευμονοπάθειας, υποψίες για ανεπάρκειά της μπορούν να υπάρξουν σε ασθενείς με μέτρια έως σοβαρή ΧΑΠ πριν από την ηλικία των 50 ετών, με οικογενειακό ιστορικό έλλειψης της α1-αντιθρυψίνης, σε χρόνια βρογχίτιδα με απόφραξη των αεραγωγών σε ασθενείς που δεν έχουν καπνίσει ποτέ, σε βρογχεκτασίες ελλείψει σαφών παραγόντων κινδύνου, ή σε κίρρωση του ήπατος, επίσης χωρίς προφανείς παράγοντες κινδύνου.
- Άλλοι γενετικοί παράγοντες: μόνο μία μειοψηφία καπνιστών είναι ευάλωτοι και αναπτύσσουν ΧΑΠ, αν και υπάρχει μία έκδηλη οικογενής τάση της νόσου σε ασθενείς που έχουν πρώιμη έναρξη της νόσου. Μακροχρόνιες γενετικές μελέτες, υποδεικνύουν μία πολυγονιδιακή επίδραση, με συχνότερη την αυτοσωμική υπολειπόμενη κληρονομικότητα. Στα γονίδια που πιθανώς εμπλέκονται συμπεριλαμβάνονται εκείνα που κωδικοποιούν τον TNFα - ένας πολυμορφισμός στην περιοχή προώθησης του TNFα προδιαθέτει σε κακή πρόγνωση της ΧΑΠ, το γονίδιο της μικροσωμικής εποξειδικής υδρολάσης και της τρανσφεράσης της γλουταθειόνης-S.
- Χημική (π.χ έλλειψη ανοσοσφαιρινών IgA ή IgG) και κυτταρική (μακροφάγα, ουδετερόφιλα ιστιοκύτταρα) ανοσοανεπάρκεια.
- Διαταραχές της βλεννοκροσσωτής κάθαρσης: η πρωτοπαθής δυσκινησία των κροσσών είναι πολυσυστηματική νόσος εκφραζόμενη κλινικά από αντίστοιχη παθολογία των συστημάτων και των επί μέρους οργάνων που διαθέτουν ανάλογο επιθήλιο. Συγκεκριμένα, από το αναπνευστικό και τις παραρρίνιες κοιλότητες παρατηρούνται υποτροπιάζουσες αναπνευστικές λοιμώξεις, βρογχεκτασίες και επεισόδια ωτίτιδας και ιγμορίτιδας και από το γεννητικό σύστημα αμφοτέρων των φύλων παρατηρείται υπογονιμότητα. Το σύνδρομο συνδέεται σε 50% περίπου των ασθενών με αναστροφή των σπλάγχνων (σύνδρομο Kartagener). Η διάγνωση μπορεί να γίνει με τη βοήθεια βιοψίας του ρινικού βλεννογόνου και απεικόνιση της μορφολογίας των κροσσών και του προσανατολισμού τους με το ηλεκτρονικό μικροσκόπιο.
Παθογένεια της ΧΑΠ:
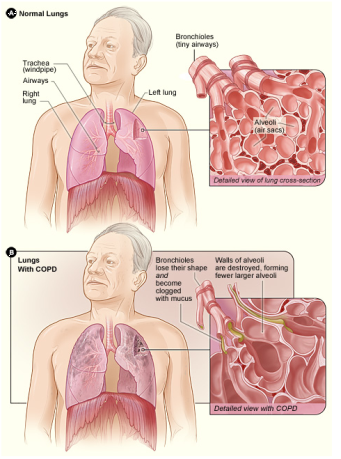
Η ΧΑΠ αναπτύσσεται στη βάση μιας φλεγμονώδους διαδικασίας, η οποία περιλαμβάνει τους βρόγχους και τις κυψελίδες, και οδηγεί σε απόφραξη των μικρών αεραγωγών με ή χωρίς εμφύσημα. Αιτία για την εμφάνιση αυτών των διαδικασιών είναι το αυξημένο οξειδωτικό στρες και μια ανισορροπία μεταξύ των πρωτεασών και των αντιπρωτεασών.
Η εισπνοή βλαβερών ουσιών και κυρίως του καπνού οδηγεί σε ενεργοποίηση των μακροφάγων και των Τ-βοηθητικών κυττάρων, που απελευθερώνουν διάφορους μεσολαβητές, οι οποίοι με την σειρά τους οδηγούν σε μετανάστευση των ουδετερόφιλων κοκκιοκυττάρων στον βρογχικό βλεννογόνο. Το αποτέλεσμα όλων αυτών είναι απελευθέρωση των πρωτεασών (μεταλλοπρωτεϊνάσες θεμέλιας ουσίας, πρωτεάσες σερίνης και κυστεΐνης) από τα κοκκιοκύτταρα και τα μακροφάγα, τα οποία επιτίθενται και καταστρέφουν την πνευμονική θεμέλια ουσία.
Η καταστροφή του πνευμονικού ιστού ενισχύεται από την απενεργοποίηση των κυτταρικών αντιπρωτεασών (π.χ. α1-αντιθρυψίνη) από εξωγενείς ουσίες του αέρα που εισπνέονται (μεταξύ άλλων νικοτίνη, SO2, SH, NOX, O3, χλωριούχα αέρια, φωσγένιο, φορμαλίνη) που οδηγούν τελικά σε ανισορροπία μεταξύ των πρωτεασών και των αντιπρωτεάσων.
| Φλεγμονώδη κύτταρα που συμμετέχουν στη παθογένεια της ΧΑΠ | ||
| Τοποθεσία | Φλεγμονώδη κύτταρα | Έκβαση νόσου |
| Τραχεία και βρόγχοι διαμέτρου >2mm |
Μακροφάγα, CD8+ Τ-λεμφοκύτταρα Ουδετερόφιλα και ηωσινόφιλα σε σοβαρές καταστάσεις |
Αυξημένος αριθμός καλυκοειδών κυττάρων που προκαλεί αυξημένη παραγωγή βλέννης |
| Βρογχιόλια διαμέτρου <2mm | Μακροφάγα, CD8+ Τ-λεμφοκύτταρα, Β-λεμφοκύτταρα, ινοβλάστες και ουδετερόφιλα | Πάχυνση των τοιχωμάτων των αεραγωγών, περι-βρογχική ίνωση και στένωση αεραγωγών |
| Αναπνευστικά βρογχιόλια και κυψελίδες | Μακροφάγα, CD8, Τ-λεμφοκύτταρα | Καταστροφή των τοιχωμάτων των κυψεΑίδων και απόπτωση κυψελιδικών κυττάρων |
| Πνευμονικά αγγεία | Μακροφάγα, CD8, Τ-λεμφοκύτταρα | Πνευμονική υπέρταση |
Η αναπτυσσόμενη χρόνια επίμονη φλεγμονή του βρογχικού βλεννογόνου επιφέρει μια αναδιαμόρφωση (remodeling) της αναπνευστικής οδού αφού μέσω της επανειλημμένης βλάβης και των επακόλουθων διαδικασιών επιδιόρθωσης σχηματίζεται ουλώδης ιστός, από το κολλαγόνο που εναποτίθεται στο τοίχωμα των βρόγχων με άμεσο αποτέλεσμα την μόνιμη στένωση του αυλού τους, που γίνεται πιο εμφανής κυρίως στα περιφερικά βρογχιόλια (small airway disease).
Η διόγκωση της βλεννογόνου της αναπνευστικής οδού σε συνάρτηση με την διαρκή αύξηση του τόνου των λείων μυών που προκαλείται από τον χρόνιο ερεθισμό των βρογχικών μυών, μειώνει τον βρογχικό όγκο και αυξάνει έντονα την αναπνευστική αντίσταση κατά την εκπνοή.
Στα προχωρημένα στάδια της ΧΑΠ παρατηρείται επίσης μια αυξημένη παραγωγή και έκκριση βλέννας από τους βρογχικούς αδένες, που σε συνδυασμό με μια επιβραδυμένη ενδοβρογχική κάθαρση της βλέννας λόγω της απώλειας της δράσης και της κατάστασης των κροσσών, μπορεί ακόμα και να αποφράξει πλήρως τους περιφερικούς βρόγχους.
Στην περαιτέρω εξέλιξη, σαν συνέπεια της χρόνιας καταστροφής των κυψελιδικών τοιχωμάτων, παρατηρείται μια παθολογική αύξηση στο μέγεθος των αεροφόρων χώρων περιφερικά των τελικών βρογχιολίων που οδηγεί σε απώλεια της φυσιολογικής ελαστικότητας των πνευμόνων και ανάπτυξη της τυπικής εικόνας του πνευμονικού εμφυσήματος που με την σειρά του οδηγεί σε περαιτέρω περιορισμός της ροής του αέρα.
Πηγή:
- The Global Initiative for Chronic Obstructive Lung Disease (GOLD).
- Frank Richling - FACTS XΑΠ (Χρόνια Αποφρακτική Πνευμονοπάθεια).
- Richard Russell, Paul Ford, Peter Barnes, - Managing COPD - A Guide to Total Patient Care.